Авторы и вывод в конце
Абстракт
Митохондрии являются динамическими органеллами в скелетных мышцах имеющих решающее значение в физической деятельности и болезнях. Жизненный цикл митохондрий охватывает биогенез, жизнь и смерть (очищение). Тренировки могут способствовать каждому из этих процессов, иметь положительное воздействие на сократительные и метаболические функции скелетных мышц. Данный обзор посвящен регуляции этих процессов в следствии тренировок выносливости и также рассматривает потенциальную пользу для улучшения здоровья и борьбы с болезнями.
Ключевые слова
Скелетные мышцы; адаптация вызванная тренировками; митохондриальный биогенез; митохондриальное деление;слияния митохондрий; аутофагия; митофагия
Введение
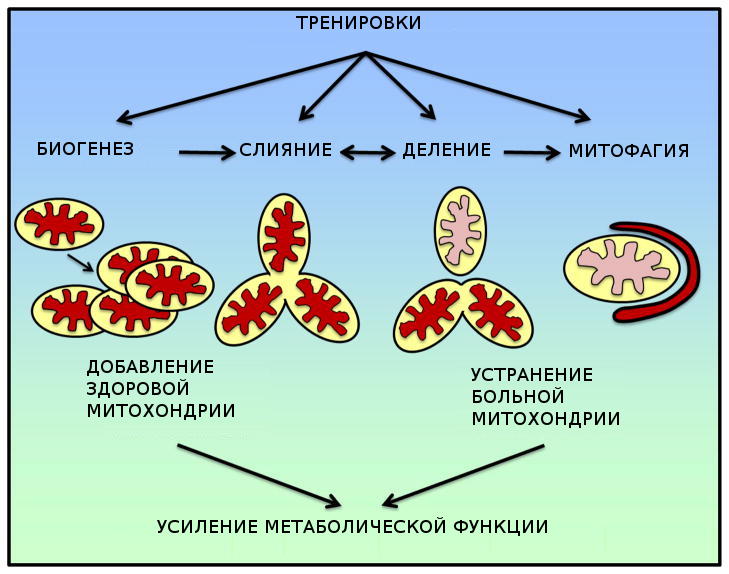
Рисунок 1. Схематическое представление работы митохондрий в ответ на физические нагрузки, тренировки. Упражнения воздействуют на биогенез, слияние, деление, и митофагию в целях повышения метаболической функции.
Давно признано, что упражнения на выносливость не только повышают физическую работоспособность, но также положительно влияют на здоровье. Наиболее изученные фенотипические адаптации в скелетных мышцах в следствии регулярных тренировок это — увеличивается васкуляризация (ангиогенез, создание новых капилляров), мышечные волокна преобразуются в окислительные мышечные волокна и увеличение количества митохондрий, улучшается их функция (производительность?).
Обширная работа была проделал в попытке понять молекулярные механизмы , которые регулируют митохондриальный биогенез, процесс, посредством которого формируются новые митохондрии. Эти усилия завершились открытием peroxisome proliferator-activated receptor-γ coactivator-1α (PGC-1α) (38) и открытием его функции в митохондриальном биогенезе вызываемом тренировками в скелетных мышцах.
Интересно, данные Кригера и др. (20) показывают, что физические упражнения улучшают функцию находящийся под сарколеммой части митохондрии. Физические упражнение не только умножают количество органелл, но и улучшают функцию, эффективность митохондриальных сетей/бассейнов. Улучшение функции является результатом не только увеличения митохондриальной сети в следствие биогенеза митохондрий, но и уничтожением нефункциональных и поврежденных митохондрий. Другими словами, митохондриальный биогенез является критическим, но возможно далеко не единственным фактором улучшения производительности митохондриальной сети в скелетных мышцах.
Хотя обсуждение функций митохондрий выходит за пределы данного обзора, известно, что это органеллы несут ответственность не только за аэробный синтез аденозинтрифосфата (АТФ), но также могут влиять на гомеостаз кальция (Ca 2+) окислительно-восстановительные процессы (состояние/потенциал?) в мышечных клетках.
На самом деле тренировки влияют положительно на все процессы в скелетных мышцах. Тем не менее, митохондрии, как и другие органеллы, повреждаются, и митохондриальная ДНК особенно чувствительна к deletions (повреждениям?), вызванным окислительным стрессом и старением по сравнению с ДНК ядра клетки (26).
Поэтому, крайне важно, не только создавать новые митохондрии, но и уничтожать поврежденные и неправильно работающие митохондрии. Регулирование этого жизненного цикла митохондрий, от биогенеза новых митохондрий к удалению поврежденных митохондрии, в конечном счете, определяет общий объем, и наиболее важно, качество и функцию митохондрий в скелетных мышцах, которые являются детерминантой метаболической функции и физической работоспособности (Рис. 1).
Процессы <тренировки> позволяют запустить программы замены старых, нездоровых митохондрии на новые, здоровые митохондрии; аналогично замене старых автомобилей с низкой эффективностью по потреблению бензина на новые автомобили, с бОльшей топливо-эффективностью для очистки окружающей среды. В этом обзоре мы представляем данные, свидетельствующие, что физические упражнения стимулируют не только биогенез митохондрий, но и удаление старых и больных митохондрий через митохондриальную динамику и аутофагию.
Биогенез
Наша лаборатория опубликовала обзор по митохондриальному биогенезу, смене типов волокон и ангиогенезу в скелетных мышцах (50). Здесь мы стараемся обобщить современное <на июль 2012 года> понимание митохондриального биогенеза в следствие тренировок, и учесть новейшие концепции в этой области. В течение многих десятилетий, исследователи изучали механизмы адаптации в ответ на тренировки направленные на развитие выносливости и обнаруживали увеличение плотности митохондрий, либо косвенно оценивали по выбросу маркеров митохондрий (например, цитохром с оксидаза-IV [ЦОГ-IV] (oxidase-IV [COX-IV]) ), или наблюдали через просвечивающий электронный микроскоп (ПЭМ / TEM), функцию митохондрий, измеряли активность ферментов митохондрий и измеряли потребление кислорода. Хотя хорошо известно, что процесс биогенеза митохондрий требует скоординированной работы, регуляции как ядерной ДНК <ядра клетки>, так и митохондриального генома, основные механизмы адаптации остается неясны. Открытие PGC-1α в бурой жировой ткани, первоначально как регулятора адаптивного термогенеза в ответ на холод, вызвало появление интереса к выяснению молекулярных и сигнальных механизмов, лежащие в основе митохондриального биогенеза в скелетных мышцы от тренировок. Биохимически идентифицирован в качестве со-активатора peroxisome proliferator-activatedreceptor-γ (PPARγ), PGC-1α является коактиватор (кофактор/соактиватор?) огромного числа факторов транскрипции,в том числе семейства PPAR факторов транскрипции, ядерных дыхательных факторов (ФПР/NRFs),транскрипционных факторов активировации митохондрий (TFAM) и многих других (28, 37). PGC-1α действительно является ко-активатором ядерных и митохондриальных генов необходимых для синтеза органелл. В данной теме <синтеза митохондрий?> PGC-1α индуцированные транскрипционные факторы, PGC-1α в настоящее время считается «главным регулятором» митохондриального биогенеза. Последние данные от Ugoccioni и соавт. (45) предполагают, что другие факторы действуют лишь параллельно с PGC-1α, чтобы улучшить митохондриальную жизнеспособность и их функции. Тем не менее, только в последнее время ставятся вопросы о том, что PGC-1α индуцируется в скелетных мышцах с помощью физических упражнений и является ли его индукция необходимым и достаточным для стимулирования митохондриального биогенеза. Короткий ответ на эти вопросы в настоящее время — громкое ДА.
Избыточная экспрессия PGC-1α повышает митохондриальный биогенез и дефицит PGC-1α снижает эффект упражнений на выносливость (снижает митохондриальный биогенез)
Работы Лейк и др. (22) показали, что у мышей с полностью удаленным геном PGC-1α показывали нормальные результаты при беге в колесе, мыши были способны индуцировать экспрессию генов отвечающих за окисление в скелетных мышцах. Однако последующие работы с использованием этой же модельной мыши привели к выводу, что PGC-1α, действительно необходим для вызываемой тренировками защиты от спада в окислительной функции (активности цитрат-синтазы) и экспрессии генов антиоксидантов (супероксид дисмутаза 2 [SOD2]) (21). Важно понимать, что глобальное удаления гена может непосредственно влиять на другие метаболически активные ткани,в том числе бурый жир и нервную ткань. Эффекты, влияющие на многие органы, в сочетании с повышенной активностью AMP-активированной протеин киназы (AMPK) в скелетных мышцах находящихся в состоянии покоя, можно решить разграничив роли PGC-1α в скелетных мышцах, особенно в следствие тренировочных упражнений (25). Совсем недавно, были созданы мыши у которых был выключен только мышечный PGC-1α (15), и данные, полученные от этих мышей показали, что в то время как смена типа волокон (fiber type transformation) в следствие упражнений был как и у прочих мышей, митохондриальный биогенез и ангиогенез в скелетных мышцах были значительно ослаблены у измененных мышей (11). Эти результаты указывают на необходимость PGC-1α для нормальной метаболической адаптации в ответ на тренировки, в том числе митохондриального биогенеза, в скелетных мышцы. Учитывая предыдущий вывод у Лин и др. (24), что трансгенные мыши в скелетных мышцах которых сверхэкспрессия (повышенная выработка) PGC-1α вызывала усиленную экспрессию митохондриальных генов, повышенную сопротивляемость усталости, и трансформация типов волокон к окислительному типу миофибрилл; Теперь мы допускаем, что усиление активности PGC-1α достаточно для индуцирования митохондриального биогенеза, преобразование типа волокна, и ангиогенеза. Тем не менее, активность PGC-1α необходима только для индукции митохондриального биогенеза и ангиогенеза.
PGC-1α регулирование за счет упражнений
Относительное много опубликованных данных документируют экспрессию PGC-1α в ответ на упражнения и тренировки. Текущий консенсус таков, что тренировки как силовые, так и направленные на выносливость усиливают экспрессию и транскрипцию PGC-1α (3, 7, 10). Более поздние данные от Перри и др. (35) показали, что даже одного упражнения (=подхода?) было достаточно, чтобы вызвать выработку PGC-1α белка и информационной рибонуклеиновой кислоты (иРНК /mRNA) в скелетных мышцах, но увеличение маркеров митохондриального биогенеза может наблюдаться только после третьего подхода. Интересно, что уровни PGC-1α и иРНК возвращались к исходному уровню после каждого подхода, и индукцию PGC-1α уменьшалась с каждым подходом. Эти результаты показывают, что механизм передачи сигналов на транскрипцию гена PGC-1α таков, что механизм может чувствовать стресс управлять адаптации.
Вызванный физической нагрузкой митохондриальный биогенез можно также регулировать с помощью направленной активации PGC-1α, индикатором которой является его транслокация в ядре (43), и это адаптивный процесс может начинают до повышенной экспресии PGC-1α (48). Интересно, Сафдар и др. (41) показали, что один подход упражнений увеличивает уровень PGC-1α не только в ядре, но и в митохондрии. Кроме того, повышенная экспрессия PGC-1α также была связана с расширением взаимодействия между PGC-1α и TFAM в митохондриальной ДНК D-петли, а также увеличении связывания PGC-1α с NRF-1 промоутера в ядре. Таким образом, упражнения не только способны индуцировать экспрессию белка PGC-1α, но и транслокация PGC-1α в необходимых отсеках, чтобы стимулировать транскрипцию ядерно и митохондриально закодированных митохондриальных генов, а также репликации митохондриальной ДНК.
Прим. переводчика — 95% митохондриальной ДНК находится в ядре клетки, а не в самой митохондрии
PGC-1α также регулируется посттрансляционной модификацией, такой как фосфорилирование и деацетилирование. Например, PGC-1α может быть деацетилируем сиртуином sirtuin (silent mating typeinformation regulation 2 homolog) 1 (SIRT1). Хотя нет никакой корреляции между общим содержанием в мышце SIRT1 и PGC-1α или митохондриального биогенеза, активация SIRT1 связана с увеличением экспрессии гена-мишени PGC-1α, в соответствии с активацией SIRT1 PGC-1α через деацетилирование (14). Интересно, что этот SIRT1-опосредованная активация PGC-1α требует фосфорилирование PGC-1α по AMPK (4). Дело в том, что активность PGC-1α контролируется и транскрипционно и посттранскрипционно, что показывает элегантность системы регулирования, которая работает с большой точностью, в связке как с сократительной так и с метаболической адаптацией скелетных мышц к упражнениям.
Экспрессия PGC-1α и активность в значительной степени регулируется выше по ходу сигнальных путей протеинкиназ. Две основные протеинкиназы участвующие в регуляции PGC-1α в скелетных мышцах являются AMPK (18) и p38γ митоген-активируемой протеинкиназы mitogen-activated protein kinase (p38γ MAPK)(1, 36). По крайней мере, два AMPK site фосфорилирования были определены на PGC-1α (18). AMPK не только активирует PGC-1α, но и способствует транскрипции гена PGC-1α(17), контролируя как экспрессию PGC-1α так и активность. Кроме того, было показано, что AMPK индуцирует экспрессию митохондриальных генов через PGC-1α (18). AMPK упоминается как «главный метаболический переключатель» регулирования энергетического метаболизма и адаптации вызванной тренировками. Тяжелые упражнения вызывают активацию через AMPK фосфорилирования в Thr172 (22). В то время как один подход? упражнения привел к увеличению активности AMPK в скелетных мышцах, длинная тренировка приводит к увеличению содержания AMPK белка (6, 43). Тем не менее, ни тяжелые, ни продолжительные упражнения не способны увеличить содержания AMPKα белка в скелетных мышцах PGC-1α дефицитных мышей, <у которых удалили ген PGC-1α> (22). Это позволяет предположить, что не только PGC-1α зависит от AMPK, но и, по меньшей мере α субъединица AMPK связана с PGC-1α.
Ранее мы показали, что один подход добровольного бега у мышей достаточно активировал путь р38 МАРК (1). Кроме того, мы показали, что р38 МАРК активность достаточно для поднятия активности PGC-1α промотора миоцитов через myocyte enhancer factor-2(MEF2) и activating transcription factor 2 (ATF2) (1). В последующих исследованиях, мы показали, что при удалении специфического для мышц гена р38 или p38β МАРК не влияет на индуцированный тренировочными упражнениями митохондриальный биогенез и ангиогенез в скелетных мышцах; Однако у мышей с удаленными мышечно-специфическими генами p38γ МАРК или PGC-1α ослабляется митохондриальный биогенез и ангиогенез (11, 36). Эти исследования впервые показали, что стимуляция р38 МАРК PGC-1α специально модулирует γ изоформы (36) и привело к выводу, что p38γ МАРК-PGC-1α регулятор механизма функционально необходим для нормального осуществления индуцированных тренировками метаболических адаптаций в скелетных мышцах.
Maintenance и митофагия
В то время как увеличение числа митохондрий от упражнений имеет крайне важное значение, поддержание здоровой популяции митохондрий может быть также важно или даже более важно. Митохондриальные повреждения, вызванных активными формами кислорода (АФК /ROS) (2), могут привести к накоплению промежуточных продуктов метаболизма (19), которые, в свою очередь, дополнительно ухудшить митохондриальную функцию и вызвать порочный круг. Эти патологические изменения, в конечном счете препятствуют способности митохондрий нормально функционировать. Вполне возможно, что эффективное удаление/уничтожение поврежденных митохондрии имеет решающее значение в поддержании общей митохондриальной функции в ткани / органе, например в скелетных мышцах. Кроме того, накопление поврежденных митохондрий, связанные с сидячим образом жизни и/или с высоким содержанием жира в диете, может ухудшить сократимость и метаболические функции скелетных мышц. Например, митохондриальная дисфункция вовлечена в развитие резистентности к инсулину (39), скорее всего, в результате избыточной продукции АФК (ROS) и накопления побочных продуктов метаболизма липидов. Таким образом, необходимо распознавать и выборочно уничтожать поврежденные митохондрии в мышцах.
Maintenance и митохондриальная динамика (передвижение/слияние/разделение/смерть?)
Митохондрии имеют форму трубчатой сети в клетках млекопитающих, которые проходят через цитозоль и существует в непосредственной близости от других важных органелл и конструкций, таких как ядро, эндоплазматическая сеть (ретикулум) и цитоскелет. Интересно то, что скелетные мышечные волокна обладают двумя разными популяциями митохондрий (т.е. находящиеся под сарколеммой и находящиеся между миофибриллами). В то время как intermyofibrillar митохондрии поддерживают относительно высокую мощность дыхания, находящиеся под сарколеммой митохондрии больше реагируют на тренировки (20). Митохондрии динамические органеллы, которые передвигаются по клетке, соединяясь и разделяясь по мере необходимости. Тем не менее, из-за физических ограничений, создаваемой плотностью сократительного аппарата в скелетных мышцах это маловероятно, что такие процессы происходят часто в разных митохондриальных популяциях в скелетных мышцах. Это соединение и разделение митохондрий из сети, называется синтез и деление, и позволяет здоровым, метаболически активным клеткам сформировать большие взаимосвязанные сети митохондрий для обмена компонентов (белки,субстраты, митохондриальная ДНК [мтДНК]) и удаление неблагополучных регионов. Таким образом, баланс между этими процессами и сигналами, ответственными за их регулирование является исключительно важным для поддержания митохондриальной сети.
Механизмы митохондриальной динамики требует участия нескольких белки. Митохондриальное слияние предполагает mitofusins 1 и 2 (MFN1 и MFN2), которые контролируют слияние митохондрий наружной мембраны, и optic atrophy type 1 (Opa1), который контролирует слияние внутренней митохондриальной мембраны. Деление митохондриального внешней мембраны млекопитающих в значительной степени контролируется dynamin-related protein 1 (Drp1), который может быть рекрутирован Fission1 (Fis1) или mitochondrial fission factor (MFF). Ранее Вестерманн опубликовал более полный обзор о аппарате митохондриальной динамики (46).
Генетические манипуляции с генами, кодирующими аппарат митохондриальной динамики показывают важность баланса между процессами синтеза и деления. Например,отключение OPA1 приводит к фрагментации митохондриальной структуры, они могут выполнять деление, но не в состоянии слиться (12). Напротив, животные с удалением сердечно-специфичного MFN2 показали аномально увеличенные находящихся под сарколеммой митохондрий, но не intermyofibrillar митохондрии в кардиомиоцитах (32). Эти выводы демонстрируют важность митохондриальной динамики <как слияния, так и деления> в поддержании нормальной, здоровой митохондриальная сети. Тем не менее, некоторые условия позволяют одному процессу доминировать над другим при обслуживании этой сети. Например, митохондриальный синтез по-видимому прекращается в деполяризованных митохондриях, в то время как митохондрии делятся чаще в деполяризованном состоянии (44). Деполяризации и деление предшествуют удалению этих митохондрий через митофигию (44), обеспечивающему регулирование митохондриальной динамики и удаление поврежденных участков митохондриальной сети.
Физическая тренировка нужна, чтобы регулировать как митохондриальные процессы слияния, так и деления. Например, семь сессий тяжелой интервальной тренировки постепенно увеличили содержание белка MFN1 и Fis1 (35). Дин и др. (8) показали также, что один подход на беговой дорожке вызвал у крыс увеличение уровней MFN1 и MFN2 мРНК, а в течении 24 часов после упражнений, белки MFN1 и MFN2 оставались на базовом уровне <уровне до упражнения?>. Cartoni др. (5) показали, что содержание MFN1 и MFN2 мРНК был увеличен в человеческой скелетной мышце на 24 ч после однократного подхода в виде упражнения на велосипеде, одновременно с увеличением в COX IV mRNA (мхДНК). Следует отметить, что езда на велосипеде индуцирует увеличивается не только PGC-1α но и α-рецепторы эстрогена (ERRα) в мРНК в течении 2 ч после тренировки до изменений в MFN1, MFN2 и COX IV. Интересно, что последующие исследования в пробирке (in vitro) показали, что транскрипция MFN1и MFN2 регулируется PGC-1α через ERRα (5). Вместе, эти результаты показывают, что PGC-1α играет важную роль в регуляции механизмов экспрессии, по крайней мере митохондриального процесса синтеза в скелетных мышцах после выполнения упражнений на тренировках. Таким образом, PGC-1α не только может регулировать митохондриальной биогенез, но также и динамику митохондриального синтеза и деления.
Mitophagy (Митофагия)
Аутофагия эволюционно консервативный процесс, который через лизосомы производит уничтожение органелл и макромолекул. Известны две основные формы аутофагии: неселективная аутофагия, которая часто стимулируется голодом и избирательная аутофагия, который может быть запущена чтобы удалить агрегаты и неправильные белки, поврежденные органеллы (например, митохондрии) (27). Начинается аутофагия, когда пре-автофагосомальная структура неизвестного происхождения порождает phagophore, который удлиняется и охватывает цель, образуя структуру с двойной мембраной известный как аутофагосома. Аутофагосома сливается с лизосомой с образованием аутофаголизосомы для выполнения деградации (33). Весь процесс требует семейство белков, называемых «аутофаго-связанные гены» (Atgs), в том числе Atg1 (также известный как Ulk1), Atg5, Atg6 (также известный в системах млекопитающих, как Beclin 1), Atg7 и Atg14. В частности, аутофагическое удаление митохондрий (митофигая) может быть главным шагом к управлению и поддержанию качества митохондрий, выбору неблагополучных, деполяризованных митохондрий через деления и слияния митохондрий. При ингибировании аутофагии (путем удаления гена Atg7) в результате снижается дыхание митохондрий в скелетных мышцах мыши и увеличивается окислительный стресс в культуре клеток (49)
В ответ на физические упражнения на выносливость в скелетных мышцах аутофагия только начинает появляться. Вольгемут и др. показал, что умеренное (8%) пожизненное ограничение калорий (CR) по отдельности или в сочетании с физическими упражнениями предотвратить старение, вызванное сокращением базальной аутофагии в скелетных мышцах крыс (47). Smuder др. (42) недавно показали, что 5 дневные упражнения на беговой дорожке менее эффективны при введении доксорубицина (агент против опухоли anti-tumor) за счет глобальной индукции аутофаго маркеров в камбаловидной мышце крыс, в то время как тренировка приводит к умеренному увеличению Atg6 мРНК и белка Atg7 в мРНК у крыс которым не вводили доксорибуцин. В итоге, эти результаты показывают, что физические упражнения помогают поддерживать экспрессию белков аутофагии по мере старения и может даже способствовать увеличению аутофагии белков в скелетных мышцах, посредством чего и получается благотворное воздействие тренировок. В этом контексте, недавние исследования показывают, что аутофагия в скелетных мышцах индуцируется тяжелыми упражнениями (13, 16, 31) и в других периферийных тканях тоже (13, 16). Что еще более важно, He и др. сообщают, что тяжелые упражнения индуцируют в склетных мышцах, но увеличение аутофагии ингибируется если у мышей не хватает трех conserved phosphorylation residues in B-cell lymphoma 2 (Bcl-2 [mice termed Bcl-2 AAA ]), которые отключают диссоциацию Atg6 от белка Bcl-2 в течение индукции аутофагии. Авторы также отметили, что физические упражнения вызывают улучшение чувствительности к глюкозе, уровни триглицеридов в крови и профили холестерина у мышей при высоком содержанием жиров в питании. Кроме того, при недостаточной активации аутофагии при выполнении физических упражнений также не идет нормальное фосфорилирование и активация AMPK и не достигают цели Acetyl CoA Carboxylase (ACC), а также транслокация glucose transporter 4 (GLUT4) к клеточной мембране скелетных мышц, что является возможным механизмом отсутствия метаболической адаптации у мышей с измененным Bcl-2 AAA . Какой механизм регулирования несет ответственность за реакцию на тяжелые упражнения в виде аутофагии и влияют ли высокообьемные, продолжительные тренировки на аутофагию в скелетных мышцах ещё предстоит изучить. Митофагия в скелетных мышцах получает всё большее внимание, особенно в контексте атрофии мышц (40, 49), но очень мало известно о ключевых белках, и сигналах, необходимые для регулирования базальных уровней митофагии. Большая часть нашего понимания митофагии идет из исследований в нервных тканях животных, на моделях нейронных заболеваний, таких как болезнь Паркинсона.
Теперь мы знаем, что среди факторов, регулирующих ключевые функциональные роли в регулировании митофагии Bcl-2 цепляется в мембранах и эндоплазматическом ретикулуме (ER) и митохондриях (34). Bcl-2 это ключевой антиапоптозный фактор, который связывается с внешней митохондриальной мембраной, также связывается с tethers Atg6 митохондриальной и эндоплазматической (ER) мембранами. Atg6 образует комплекс с Atg14, чтобы побудить формирование phagophore (23), играющие важную роль в индукции и протекании процесса аутофагии. Кроме того, Parkin и фосфатаза и гомолог ангиотензина (tensin homolog) были удалены из хромосомы 10(PTEN)-induced putative kinase protein 1 (Pink1) продемонстрировали нам путь, связанных с повреждением митохондрий и индукцией митофагии (29).
Другие белки, которые участвуют в митофагии митохондрий локализуются в BNIP3(Bcl-2, и 19 кДа-белок, взаимодействующий с protein-37) и BNIP3-подобный белок (BNIP3L) (30, 40). Форсирование выработки BNIP3 в взрослых волокнах вызывает массовую митофагию (40), и BNIP3L по видимому, участвует в механизме запуска аутофагии в митохондриях(30). Наконец два классических пути вызываемых тренировками, AMPK, «главный метаболический переключатель», и mTOR, возможно, первичный стимул синтеза белка и гипертрофии мышц, играет важную роль в аутофагорегулировании. При сравнении сути AMPK и mTOR, предыдущие данные подтверждают, что активация AMPK вызывает стимулирующее фосфорилирования Ulk1 для индукции аутофагии, в то время как mTOR в тормозит фосфорилирования Ulk1 (9). Так как эти киназы дифференциально регулируются в зависимости от режима и тяжести упражнений, они могут помочь тонкой настройке митофагии после тяжелых упражнений и как быть адаптацией к тренировкам. Тем не менее, их специфическая роль в аутофагии в скелетных мышцах еще предстоит изучить. Это захватывающая новая область исследований, а будущие исследования должны изучать белки, участвующих в процессе митофагии, а также их регулирование в контексте физических упражнений.
Резюме
Адаптация к тренировочным упражнениям очень широкая, и охватывает несколько систем органов. В скелетных мышцах, одним из наиболее важных адаптационных изменений является усиление метаболического потенциала, который помогает повысить производительность на тренировках и здоровье. Основные механизмы включают регулирование митохондриальной сети. Большое внимание уделяется в последние годы механизмам, участвующим в генерации и добавлении новых митохондрий, про которые в настоящее время известно, что они регулируется PGC-1α. Мы предлагаем реконструкцию митохондриальной сети через слияния и деления, и ликвидацию поврежденных / неблагополучных митохондрий через адаптацию в виде митофагии вызванную тренировками . Этот процесс замены старых, нездоровых митохондрии на новые, здоровые митохондрии показывает повышенное количество и качество митохондрий в скелетных мышцах в следствии физических упражнений (рис. 1).
Толкование статьи от переводчика —
- Митохондрии надо не только создавать, но и убивать (в разумных пределах), и это будет только повышать результаты на соревнованиях, улучшать здоровье, поскольку есть слабые, старые и неэффективные митохондрии.
- Генетические сбои, неудачные мутации (ангиогенеза, деления и слияния
митохондрий) могут быть абсолютным препятствием для тренировки
выносливости и роста митохондрий, росту потребления кислорода, сводя к
мизеру результаты тренировок у людей с неудачными мутациями, и выводя на
первый план генетический отбор (роль которого 80%) спортсменов с
удачными вариантами мутаций соответствующих генов, а не сами тренировки,
которые скорее являются инструментом (ситом) отбора чем фактором роста
спортивной формы, роль которых 10-20%.
Авторы
Чжэнь Янь, доктор, Витор А. Лира, доктор и Николас П. Грин, доктор
Отдел медицины и фармакологии, Центр исследований скелетных мышц имени Роберта М. Берна Сердечно-сосудистый исследовательский центр, Университет Вирджинии, Шарлоттсвилль, В. А. 22908
Опубликовано в Exerc Sport Sci Rev. 2012 июль ; 40(3): страницы 159–164 doi:10.1097/JES.0b013e3182575599.
Откуда инфа, что 95% митохондриальной ДНК в ядре клетки? Это что-то новое, если в клетке убить абсолютно все митохондрии, то в этой клетки их больше никогда не будет — клетка не умеет сама создавать митоходрии, на сколько мне было известно. И вообще, митохондриальная ДНК имеет другое стороение и другое происхождение, чем ядерная.
4 цитата, 1 о том как ученые гены мышей улучшали, 3 как их выключали. Вполне логично, что и у человека, десятки ключевых генов и у человека, могут быть в состоянии нормы, хуже или лучше нормы. На эту тему информацию, что за гены важны тоже можно собрать и выложить, точнее она уже есть, но без пояснений, гены кодирующие метаболические процессы например. Есть исследование, которое можно перевести где порядка 1600 спортсменов видов спорта на выносливость взяли и сравнили их геномы с нетренированными, с штангистами.
- трансгенные мыши в скелетных мышцах которых сверхэкспрессия (повышенная выработка) PGC-1α вызывала усиленную экспрессию митохондриальных генов, повышенную сопротивляемость усталости, и трансформация типов волокон к окислительному типу миофибрилл; Теперь мы допускаем, что усиление активности PGC-1α достаточно для индуцирования митохондриального биогенеза, преобразование типа волокна, и ангиогенеза.
- Тем не менее, ни интенсивные? (acute), ни продолжительные упражнения не способны увеличить содержания AMPKα белка в скелетных мышцах PGC-1α дефицитных мышей, <у которых удалили ген PGC-1α> (22). Это позволяет предположить, что не только PGC-1α зависит от AMPK, но и, по меньшей мере α субъединица AMPK связана с PGC-1α.
- Однако у мышей с удаленными мышечно-специфическими генами p38γ МАРК или PGC-1αослабляется митохондриальный биогенез и ангиогенез (11, 36)
- Совсем недавно, были созданы мыши у которых был выключен только мышечный PGC-1α (15), и данные, полученные от этих мышей показали, что в то время как смена типа волокон (fiber type transformation) в следствие упражнений был как и у прочих мышей, митохондриальный биогенез и ангиогенез в скелетных мышцах были значительно ослаблены у измененных мышей (11). Эти результаты указывают на необходимость PGC-1α для нормальной метаболической адаптации в ответ на тренировки, в том числе митохондриального биогенеза, в скелетных мышцы
Митохондрия — полезный паразит (симбиот) как считают ученые.
Информацию о том, что бОльшая часть генома митохондрии мигрировала в ядро я услышал в одной из лекции о митохондриях и строении клетки (не Селуянова).
Поискал источники, в википедии есть упоминание об этом, не думаю что это секретная или новая информация…
Wiki: "Сравнительный анализ геномов митохондрий показывает, что в ходе эволюции происходило постепенное перемещение генов предков современных митохондрий в ядро клетки"
Ленинджер: "свыше 95% митохондриальных белков кодируется ядерной ДНК"
Речь, наверно, про горизонтальный перенос генов. Точно также ядерная днк содержит гены некоторых древних вирусов. В целом, я думаю, это не значит, что будет влияние на размножение митохондрий.
По митоходриям есть в ютьюбе интересные лекции у К.Северинова. В частности обсуждается, как митохондрии наследуются от матери и можно найти общего предка — митоходриальную Еву. В сперматазоиде нет митоходрий, поэтому отец не передаёт информацию о своих митоходриях детям.
